Hitunglah Konsentrasi Masing Masing Spesi Dalam Larutan Asam Lemah H2co3
Hitunglah Konsentrasi Masing-Masing Spesi dalam Larutan Asam Lemah H2CO3: Memahami Keseimbangan Ionisasi dan Aplikasinya
Dalam kimia larutan, memahami konsentrasi masing-masing spesi kimia dalam suatu larutan sangat penting untuk berbagai perhitungan dan interpretasi fenomena yang terjadi. Salah satu kasus menarik yang perlu disorot adalah menentukan konsentrasi spesi dalam larutan asam lemah seperti H2CO3 (asam karbonat). Artikel ini akan membahas secara mendalam mengenai bagaimana menghitung konsentrasi masing-masing spesi dalam larutan H2CO3, beserta pemahaman konseptual di baliknya dan aplikasinya dalam bidang ilmu pengetahuan.
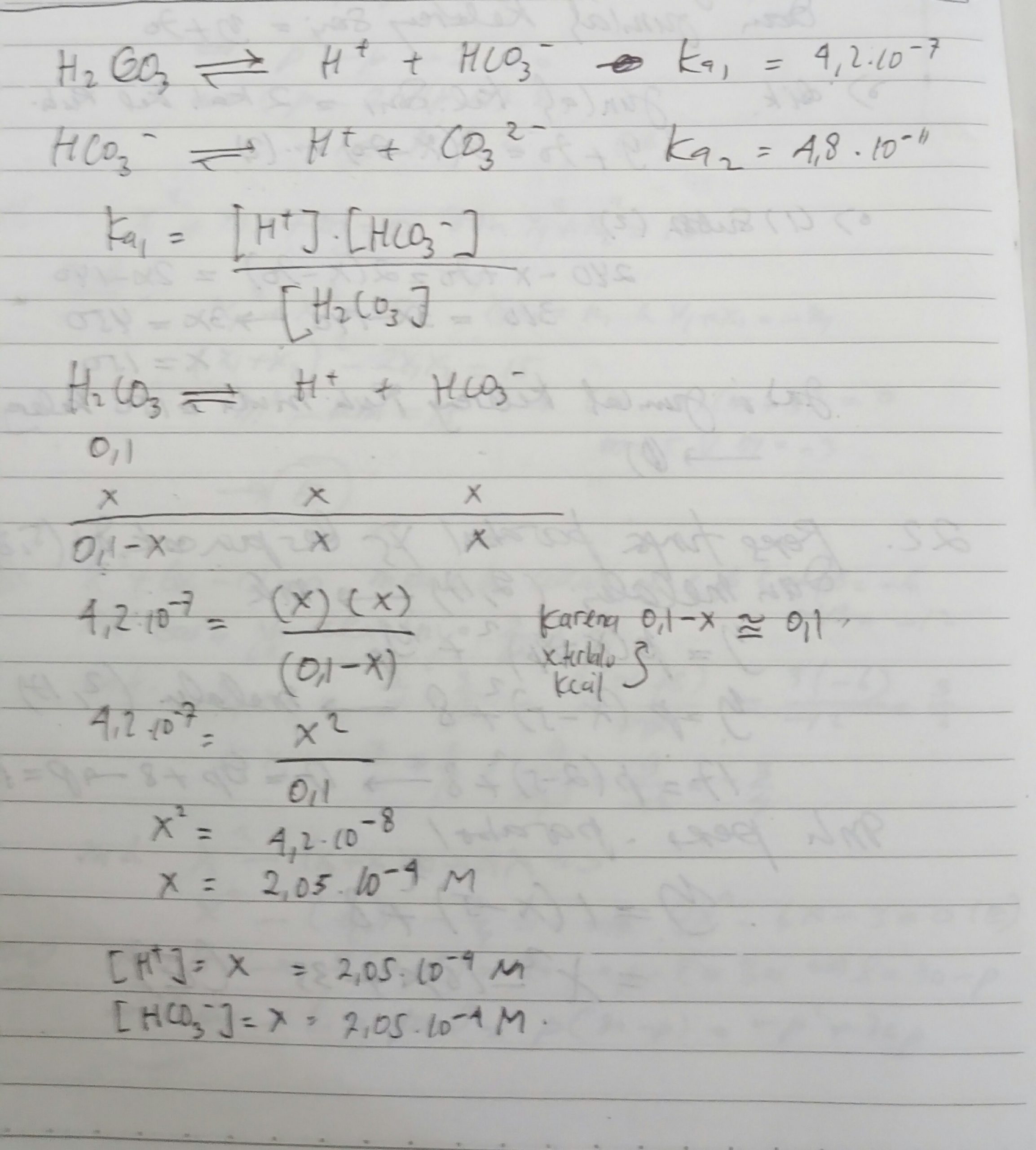
Apa yang Dimaksud?
Hitunglah konsentrasi masing-masing spesi dalam larutan H2CO3 merupakan pertanyaan terkait dengan keseimbangan ionisasi dalam larutan asam lemah. Asam lemah seperti H2CO3 terdisosiasi secara terbatas dalam air, menghasilkan ion H+ dan ion karbonat (CO3²⁻). Perhitungan konsentrasi masing-masing spesi melibatkan pemahaman keseimbangan kimia dan penerapan konstanta keseimbangan asam (Ka).
Bagaimana Mencapainya?
Untuk menghitung konsentrasi masing-masing spesi dalam larutan H2CO3, langkah-langkah berikut dapat ditempuh:
1. Tuliskan Persamaan Disosiasi: H2CO3 ⇌ H+ + CO3²⁻
2. Tentukan Persamaan Keseimbangan: Ka = [H+][CO3²⁻] / [H2CO3]
3. Gunakan Nilai Ka dan Konsentrasi Awal: Kita membutuhkan nilai Ka (konstanta keseimbangan asam) H2CO3 dan konsentrasi awal H2CO3 dalam larutan.
4. Susun dan Selesaikan Persamaan Kuadrat: Persamaan yang terbentuk biasanya berupa persamaan kuadrat yang perlu diselesaikan untuk mendapatkan konsentrasi ion H+.
5. Hitung Konsentrasi Lainnya: Mengetahui konsentrasi [H+], gunakan stoikiometri dan persamaan keseimbangan untuk menghitung konsentrasi [CO3²⁻] dan [H2CO3] yang tersisa.
Apa yang Sudah Diketahui?
- H2CO3 merupakan asam lemah yang mengalami ionisasi terbatas dalam air.
- Keseimbangan disosiasi H2CO3 dapat digambarkan menggunakan persamaan kimia dan konstanta keseimbangan asam (Ka).
- Penghitungan konsentrasi spesi membutuhkan nilai Ka dan konsentrasi awal H2CO3.
Solusi yang Ditawarkan:
Artikel ini menyediakan kerangka kerja untuk menghitung konsentrasi masing-masing spesi dalam larutan H2CO3. Dengan memahami langkah-langkah yang dijelaskan dan menerapkannya pada kasus spesifik, Anda dapat menghitung konsentrasi ion H+, CO3²⁻, dan H2CO3 yang tersisa dalam larutan.
Informasi Tambahan:
- Pemahaman keseimbangan ionisasi dalam larutan asam lemah seperti H2CO3 tidak hanya berguna untuk perhitungan konsentrasi, tetapi juga berperan penting dalam memahami pH larutan, kekuatan asam, dan berbagai fenomena kimia lainnya.
- Penghitungan keseimbangan dalam larutan asam lemah melibatkan pendekatan iteratif dan estimasi awal yang terkadang perlu disesuaikan. Kemahiran menggunakan kalkulator ilmiah dan perangkat lunak kimia dapat mempermudah proses perhitungan.
Baca Juga : Berikut Ini Adalah Konsep Yang Mengandung Prinsip-prinsip Governance, Kecuali
Kesimpulan:
Menghitung konsentrasi masing-masing spesi dalam larutan H2CO3 merupakan contoh aplikasi pemahaman keseimbangan ionisasi dalam larutan asam lemah. Melalui metode perhitungan yang sistematis dan pemahaman konseptual yang kuat, kita dapat memprediksi perilaku kimiawi larutan secara akurat dan membuka jalan untuk eksplorasi berbagai fenomena terkait.
5 Pertanyaan tentang Konsentrasi Spesi Dalam Larutan Asam Lemah H2co3
1. Apa perbedaan perhitungan konsentrasi dalam asam lemah dan asam kuat? Perhitungan dalam asam lemah melibatkan keseimbangan dan iterasi, sedangkan perhitungan dalam asam kuat umumnya langsung menggunakan konsentrasi awal dan stoikiometri.
2. Pengaruh apa yang dimiliki suhu terhadap keseimbangan ionisasi H2CO3? Peningkatan suhu umumnya mendorong disosiasi asam lemah, sehingga konsentrasi ion H+ dan CO3²⁻ meningkat.
3. Apakah perhitungan keseimbangan dalam H2CO3 memperhitungkan ionisasi air? Ya, meskipun kontribusinya terhadap [H+] biasanya diabaikan dalam larutan asam lemah dengan konsentrasi awal yang cukup tinggi.
4. Bagaimana konsep keseimbangan H2CO3 diterapkan dalam bidang lain? Pemahaman keseimbangan asam-basa berperan penting dalam biologi, farmasi, ilmu lingkungan, dan berbagai bidang terkait.